RG Prof. Petra Dietrich
Forschungsprojekte
Ionenkanäle und Signaltransduktion
Die Forschung der AG Zellbiologie der Pflanze konzentriert sich auf die Untersuchung der Biophysik und der Physiologie von Kationenkanälen in der Modellpflanze Arabidopsis thaliana.
Kanäle sind für den Ionentransport und für die Kontrolle des Membranpotentials mit verantwortlich. Sie können auch an der Entstehung von Ca2+-Signalen als Informationsträger in Signaltransduktionsketten beteiligt sein. Ziel unserer Untersuchungen ist es, die Einbindung von Kationenkanälen in Signalnetzwerke aufzuklären sowie die Mechanismen zu verstehen, die zelluläre Ca2+-Antworten steuern.
Kationenkanäle für Wachstum und Stressmanagement
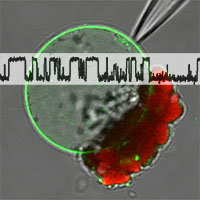 Transportprozesse werden in komplexen, bislang wenig verstandenen Regelkreisen über verschiedene Membransysteme hinweg koordiniert. Vor allem die pflanzliche Zentralvakuole, das Organell, welches 80-90% des Zellvolumens einnimmt, dient als großes Reservoir für Ionen und Metabolite. Zum Verständnis der intrazellulären Kommunikation zwischen der Plasma- und Vakuolenmembran wird ein möglichst vollständiges Bild der Regulationsmechanismen an beiden Membransystemen angestrebt. Die Bedeutung des Ionentransports für die Osmoregulation pflanzlicher Zellen wird in einem Teilprojekt des Graduiertenkollegs 1962 untersucht, bei dem die Aufklärung membrangebundener Regulationsprozesse im Vordergrund steht. Ionenkanäle in der Vakuolenmembran untersuchen wir am Beispiel des Zwei-Poren-Kanals TPC1 (two pore channel 1). Mit Hilfe der gezielten Mutagenese und anschließender biophysikalischer Untersuchung der Mutanten werden die Funktionsdomänen des Kanals identifiziert und charakterisiert, welche für das Protein-Targeting in die Vakuolenmembran, die Ca2+-abhängige Aktivierung und die Regulation der Aktivität verantwortlich sind. Für die konfokalmikroskopische Lokalisation und die elektrophysiologische Funktionsanalyse werden die TPC1-GFP Fusionsproteine in Zellen aus TPC1-Kanalverslustmutanten exprimiert.
Transportprozesse werden in komplexen, bislang wenig verstandenen Regelkreisen über verschiedene Membransysteme hinweg koordiniert. Vor allem die pflanzliche Zentralvakuole, das Organell, welches 80-90% des Zellvolumens einnimmt, dient als großes Reservoir für Ionen und Metabolite. Zum Verständnis der intrazellulären Kommunikation zwischen der Plasma- und Vakuolenmembran wird ein möglichst vollständiges Bild der Regulationsmechanismen an beiden Membransystemen angestrebt. Die Bedeutung des Ionentransports für die Osmoregulation pflanzlicher Zellen wird in einem Teilprojekt des Graduiertenkollegs 1962 untersucht, bei dem die Aufklärung membrangebundener Regulationsprozesse im Vordergrund steht. Ionenkanäle in der Vakuolenmembran untersuchen wir am Beispiel des Zwei-Poren-Kanals TPC1 (two pore channel 1). Mit Hilfe der gezielten Mutagenese und anschließender biophysikalischer Untersuchung der Mutanten werden die Funktionsdomänen des Kanals identifiziert und charakterisiert, welche für das Protein-Targeting in die Vakuolenmembran, die Ca2+-abhängige Aktivierung und die Regulation der Aktivität verantwortlich sind. Für die konfokalmikroskopische Lokalisation und die elektrophysiologische Funktionsanalyse werden die TPC1-GFP Fusionsproteine in Zellen aus TPC1-Kanalverslustmutanten exprimiert.
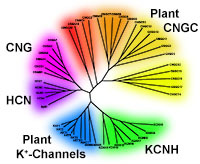 Wir wollen dazu beitragen, die physiologischen Funktionen von Kationenkanälen aufzuklären. Derzeit konzentrieren wir uns auf Mitglieder aus der Familie der ligandenaktivierten Kanäle (cyclic nucleotide gated channels CNGC). Einzelnen Mitgliedern konnte bereits eine Funktion in Wachstumsprozessen und Stressantworten (z.B. Pathogenbefall, Salzstress, Schwermetallstress) zugeordnet werden. Die CNG-Kanäle sind aus 6 transmembranen Helices aufgebaut. Zur Kanalpore tragen im funktionellen Tetramer die Porendomänen der vier Untereinheiten bei. Wir untersuchen die CNG-Kanäle hinsichtlich ihrer Expressionsmuster, Regulation und Beteiligung an Ca2+-Antworten. Struktur-Funktionsanalysen und Interaktionsstudien helfen, die physiologischen Funktionen der Kanäle aufzuklären.
Wir wollen dazu beitragen, die physiologischen Funktionen von Kationenkanälen aufzuklären. Derzeit konzentrieren wir uns auf Mitglieder aus der Familie der ligandenaktivierten Kanäle (cyclic nucleotide gated channels CNGC). Einzelnen Mitgliedern konnte bereits eine Funktion in Wachstumsprozessen und Stressantworten (z.B. Pathogenbefall, Salzstress, Schwermetallstress) zugeordnet werden. Die CNG-Kanäle sind aus 6 transmembranen Helices aufgebaut. Zur Kanalpore tragen im funktionellen Tetramer die Porendomänen der vier Untereinheiten bei. Wir untersuchen die CNG-Kanäle hinsichtlich ihrer Expressionsmuster, Regulation und Beteiligung an Ca2+-Antworten. Struktur-Funktionsanalysen und Interaktionsstudien helfen, die physiologischen Funktionen der Kanäle aufzuklären.
Für die erfolgreiche Forschung kombinieren wir eine Vielzahl molekularbiologischer, zellbiologischer und elektrophysiologischer Ansätze, darunter:
- Patch-Clamp-Analyse elektrogener Transportvorgänge
Untersuchung des Ionentransports nach Expression von Kanälen oder Transportern in Xenopus-Oocyten mittels der Zwei-Elektroden-Spannungsklemme
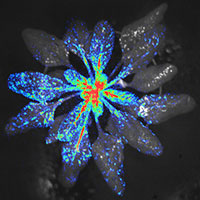 Untersuchung der Regulation und Biophysik von Ionenkanälen nach transienter oder stabiler Expression in Pflanzenzellen
Untersuchung der Regulation und Biophysik von Ionenkanälen nach transienter oder stabiler Expression in Pflanzenzellen- Parallele Untersuchung von Ionenströmen und Ca2+-Signalen in Pflanzenzellen mittels gekoppelter Patch-Clamp Technik und Fluoreszenzanalyse Ca2+-sensitiver Farbstoffe
- Proteininteraktionstests
- Phänotypische Analyse transgener Pflanzen
- Nichtinvasive Analyse von Ca2+-Antworten mittels Aequorin-Lumineszenzanalysen transgener Pflanzen
- Promotor-Reporteranalysen (GUS, Luciferase)